Qu’a-ton appris de l’analyste génétique du virus ?
Argos Panoptes
Nous observons, nous avons l’oeil !

Article republié avec l’autorisation de et d’après « THE CONVERSATION France »
Lien vers l’article original. Cliquez ce lien
Qu’a-t-on appris de l’analyse génétique du coronavirus?
Meriadeg Le Gouil, Université de Caen Normandie
Meriadeg Le Gouil est enseignant-chercheur au GRAM 2.0 (Groupe de recherche sur l’adaptation des microbes), EA2656 de l’Université de Caen Normandie et au laboratoire de virologie du CHU de Caen. Il est spécialiste des coronavirus humains et animaux, avec un intérêt particulier pour les coronavirus de la faune sauvage et les virus émergeants circulant chez les chauves-souris : l’ordre de mammifère hébergeant la plus grande diversité de ce type de virus. Dès qu’un nouveau virus apparaît, les scientifiques cherchent à établir sa séquence génétique.
Comment obtenir la séquence génétique d’un virus ?
Si l’on compare avec le SRAS : le dernier coronavirus qui avait suscité une inquiétude mondiale pour l’homme en 2002, les techniques d’analyse génétique ont drastiquement évolué vers plus de précision et des temps d’analyse réduits. Ces analyses sont également moins coûteuses ce qui a permis à de nombreux pays de s’équiper convenablement en séquenceurs génétiques. Ainsi, il est possible d’analyser très vite un nouveau virus quel que soit son lieu d’apparition.
Dans le cas du nouveau coronavirus 2019-nCoV, ce sont donc des équipes chinoises qui ont pu l’analyser et partager les informations à la communauté scientifique internationale en quelques jours à semaines grâce à une base de données appelée GISAID. Ce partage permet de comparer les résultats obtenus à partir d’autres patients. À ce jour la plupart des séquences analysées viennent de Chine mais il en existe également provenant de Thaïlande, des États-Unis et de France.
 Capture d’écran de la base de données GISAID présentant la géographie des cas du nouveau coronavirus. GISAID
Capture d’écran de la base de données GISAID présentant la géographie des cas du nouveau coronavirus. GISAIDQuelles informations découlent de cette séquence ?
Un virus, comme un être vivant, est porteur d’information génétique, à partir de laquelle il va fabriquer ses protéines et se multiplier chez son hôte. Le génome de ce coronavirus compte environ 30 000 nucléotides : une série de quatre briques élémentaires représentées par les lettres : A, U, C, G. Séquencer c’est tout simplement établir dans quel ordre ces briques sont organisées. Une fois que l’on a la liste ordonnée de 30 000 lettres, que peut-on en déduire ?
Tout d’abord, il est possible de comparer la nouvelle séquence avec celles déjà présentes dans les bases. En réalisant ce travail, l’équipe dirigée par Zhengli Shi, du Wuhan Institute of Virology a pu constater qu’un autre virus, prélevé en 2013 en Chine chez une chauve-souris, possédait un génome similaire à 95 %. Il est donc probable que 2019-nCoV (le nom scientifique de ce nouveau coronavirus) trouve son origine chez cet animal. La transmission ne s’est peut-être pas produite directement entre la chauve-souris et l’humain, car pour un passage à une autre espèce, il faut des contacts nombreux et répétés. Les scientifiques et les autorités pointent plutôt vers des marchés aux animaux vivants. L’animal intermédiaire potentiel n’a pas encore été identifié.
L’autre intérêt d’étudier la séquence génétique est de prévoir la structure des protéines du virus dont elle découle. Une des protéines d’intérêt est la protéine S (pour spicule) présente à la surface du virus et qui va s’attacher à nos cellules pour les reconnaître et les infecter. Ce sont d’ailleurs elles qui donnent sa forme de couronne au coronavirus.
Ces protéines de surface peuvent aussi être une cible thérapeutique car si on les bloque alors elles ne peuvent plus infecter des cellules. Connaître finement sa séquence a également permis de mettre au point des tests de diagnostic spécifiques.
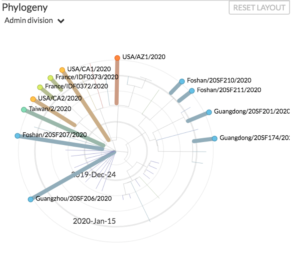
L’arbre généalogique des virus
Analyser une séquence génétique donne aussi des informations sur l’évolution des virus. A chaque fois qu’il va se répliquer, son génome va connaître des modifications : des mutations. Quelques nucléotides sur les 30 000 vont changer, ce qui peut avoir une conséquence sur la structure des protéines et potentiellement, sur la vitesse d’infection. Chaque nouvelle séquence va donc être comparée à celles déjà connues pour déceler ces mutations. Les scientifiques peuvent alors créer des « arbres généalogiques » (arbres phylogénétiques en termes techniques) pour comprendre d’où vient chaque source virale.
Chez un même individu, les virus mutent. Grâce aux dernières techniques de séquençage, il est possible d’établir toutes les séquences présentes. Cela permet de suivre les taux de mutation du virus, la diversité de ses populations à l’intérieur de l’organisme et de suivre les chaînes épidémiques.
Comment un virus animal se transmet à l’homme ?
Pour les virus, tout est une question d’opportunités. Il n’est pas aisé de franchir les barrières des espèces. Ainsi un virus affectant majoritairement les chauves-souris se transmettra difficilement à l’humain.
Pour une transmission interespèces, il est nécessaire d’avoir des opportunités écologiques, soit des contacts rapprochés, nombreux et fréquents. Ainsi pour prévenir les risques de contamination ou d’émergence de nouveaux virus, il est nécessaire de réfléchir à notre rapport avec la biodiversité. Par exemple, les chauves-souris n’ont que peu de raison de venir au contact des humains, sauf si leur habitat est détruit ou réduit. Protéger la nature et la biodiversité c’est aussi nous protéger d’éventuelles émergences et donc des maladies nouvelles.
Meriadeg Le Gouil, Virologue, Université de Caen Normandie
Cet article est republié à partir de The Conversation sous licence Creative Commons. Lire l’article original.

